الأحماض القوية تتأين بالكامل في الماء، بينما الأحماض الضعيفة تتأين جزئيا
تأين الحمض الضعيف تأين الحمض القوي
أمثلة على الأحماض القوية:
H2SO4, H2CrO4, HNO3, HCIO4, HCL, HBr, HI
من الأمثلة على الأحماض الضعيفة
حمض الخل CH3COOH وبقية الأحماض الكربوكسيلية الأخرى
تأين الحمض القوي في الماء يكون كما في معادلة
تأين الحمض الضعيف في الماء يكون
بشكل عام للحمض الضعيف HA تكتب المعادلة الكيميائية لتاينه
قوة الحمض يمكن تحديدها من خلال قيمة ثابت اتزان الحمض Ka
يعبر ثابت الاتزان للتفاعل
حيث أن الماء مذيب وكميته كبيرة جدا مقارنة بالحمض فإنه لن يتأثر تركيزه بحدوث الاتزان،
لذلك فإن تركيز الماء يعتبر ثابتا
ويمكن تضمينه ضمن ثابت الاتزان ليصبح ثابت اتزان الحمض Ka
القواعد القوية تتأين بالكامل في الماء بينما الضعيفة منها فقط تتأين جزئيا.
أمثلة القواعد القوية
KOH, NaOH
من أمثلة القواعد الضعيفة
الأمونيا والأمينات.
تتأين القاعدة القوية في الماء كما في المعادلة
تأين القاعدة الضعيفة في الماء كما في المعادلة
كما في الأحماض الضعيفة، قوة القاعدة يمكن تحديدها من خلال ثابت اتزان القاعدة Kb
مثال Kb للأمونيا هو 1.8× 10 قوة -5.
كلما زادت قيمة Kb كما كانت القاعدة أقوى.





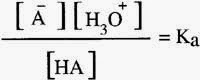

refreshments
ردحذف